
La radioattività è la disintegrazione spontanea o artificiale di un nucleo atomico accompagnata dalle emissioni di particelle cariche (beta più, beta meno, alfa, neutroni) e/o di solo energia (fotoni).
Progetto in collaborazione con l'ENEA
Per l'ENEA:
Per la scuola:
Anno scolastico 1998/1999
Titolo della ricerca: Radiazioni ionizzanti e non ionizzanti
1.1 CENNI STORICI
2.0 RADIAZIONI NATURALI ED ARTIFICIALI
2.1 RADIOATTIVITÀ NATURALE
2.1.1 Radon e Toron
2.1.2 Radiazione cosmica
2.2 RADIOATTIVITÀ ARTIFICIALE
3.0 RADIAZIONI IONIZZANTI E NON IONIZZANTI
3.1 RADIAZIONI IONIZZANTI
3.1.1 Radiazioni Alfa, Beta, Gamma
3.1.2 Interazioni delle radiazioni ionizzanti con la materia
3.1.3 Potere penetrante delle radiazioni ionizzanti
3.1.4 Unità di misura
3.2 EFFETTI DELLE RADIAZIONI IONIZZANTI
3.2.1 Effetti sui materiali
3.2.2 Effetti biologici
3.3 RADIAZIONI NON IONIZZANTI
3.3.1 Proprietà delle radiazioni non ionizzanti
3.4 PROTEZIONE ALLA RADIAZIONI
3.4.1 Protezione alle radiazioni ionizzanti
3.4.2 Protezione alle radiazioni non ionizzanti
3.5 DANNI BIOLOGICI DELLE RADIAZIONI
3.5.1 Incidente della centrale di Chernobyl
4.0 IMPIEGO DELLE RADIAZIONI IN CAMPO MEDICO, INDUSTRIALE, MILITARE
4.1 APPLICAZIONI CAMPO MEDICO
4.2 APPLICAZIONI CAMPO INDUSTRIA E RICERCA
4.3 APPLICAZIONI IN CAMPO MILITARE
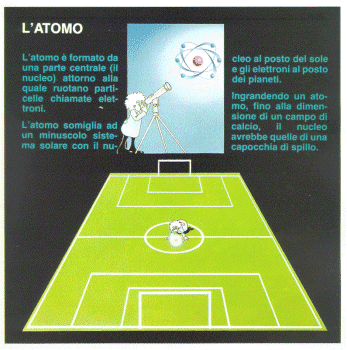 |
L’atomo è la più piccola quantità di materia che conserva le caratteristiche fisiche di un elemento. Un atomo è formato da un nucleo centrale attorno al quale ruotano vorticosamente particelle aventi carica negativa, chiamate elettroni. Il nucleo è composto da particelle pesanti elettricamente neutre, chiamate neutroni, e da particelle, chiamate protoni, aventi la stessa massa dei neutroni e carica elettrica positiva uguale come intensità a quella degli elettroni. Quando il numero degli elettroni è uguale a quello dei protoni, le loro cariche (negative e positive) si compensano e l’atomo risulta elettricamente neutro. |
La struttura di un atomo X è indicata con il simbolo:
![]()
dove A, chiamato numero di massa, è il numero totale di protoni e neutroni del nucleoe Z, chiamato numero atomico, è il numero di protoni del nucleo (uguale al numero di elettroni in un atomo elettricamente neutro).
Ad esempio: ![]() indica l’atomo
di Uranio (simbolo U) con:
indica l’atomo
di Uranio (simbolo U) con:
Z = 92 elettroni;
Z = 92 protoni (essendo elettricamente neutro);
A = 238 neutroni + protoni;
(A – Z) = 146 neutroni.

A seguito di processi particolari chiamati di ionizzazione (paragrafo 3.1), l’atomo può perdere o acquistare degli elettroni. Quando questo avviene l’atomo non risulterà più neutro. Infatti se il numero degli elettroni viene ad essere minore di quello dei protoni l’atomo avrà carica positiva, se invece il numero degli elettroni risulta maggiore è di quello dei protoni l’atomo avrà carica negativa. In questo caso gli atomi vengono chiamati ioni. In particolare nel primo caso vengono chiamati anioni e nel secondo cationi.
Gli atomi che hanno lo stesso numero di elettroni e protoni ma un numero diverso di neutroni, si chiamano isotopi. In pratica gli isotopi di un atomo differiscono dall’atomo base per il numero di massa atomico. Per esempio l’idrogeno è un atomo composto di un elettrone e un protone e nessun neutrone, isotopi dell’idrogeno sono il deuterio, composto di un elettrone un protone e un neutrone, e/o il trizio composto di un elettrone un protone e due neutroni.
clicca sull'immagine per la
versione ingrandita
Ogni processo radioattivo è caratterizzato da un tempo di dimezzamento, cioè il tempo che deve trascorrere perché metà dei nuclei instabili subiscano la trasformazione diventando un altro elemento. Ad esempio:
se abbiamo 100 atomi di Torio 232 dopo circa 14 miliardi di anni ne restano 50;
se abbiamo 100 atomi di Uranio 238 dopo circa 4,5 miliardi di anni ne restano 50;
se abbiamo 100 atomi di Radio 226 dopo circa 1600 anni ne restano 50;
se abbiamo 100 atomi di Radon 222 dopo circa 3,82 giorni ne restano 50;
se abbiamo 100 atomi di Polonio 214 dopo circa 0,00016 secondi ne restano 50.
Si possono avere diversi tipi di decadimento caratterizzati dal tipo di atomo e della sua emissione di particelle e/o energia: decadimento beta, alfa e gamma.
Il decadimento beta può
avvenire in due forme distinte a seconda del tipo di particella
che viene emessa:
decadimento beta meno (b-), durante il quale un neutrone del nucleo
si trasforma in un protone, emettendo un elettrone (particella
b-)
e un antineutrino (a sinistra nella figura).
decadimento beta più (b+), durante il quale un protone del nucleo si
trasforma in un neutrone, emettendo un positrone (particella
b+)
e un neutrino (a destra nella figura).
Quindi, un atomo che ha un decadimento b, acquista un protone perdendo un neutrone (decadimento b-) o perde un protone (decadimento b+) acquistando un neutrone. Al termine di questo processo il numero atomico Z sarà variato di una unità, mentre il numero di massa A rimane invariato.
Nel processo radioattivo detto decadimento alfa viene emessa una particella alfa, costituita da due protoni e due neutroni (esattamente come un nucleo di elio). Essa viene emessa, soltanto da nuclei atomici instabili relativamente pesanti (con molti protoni e neutroni). In seguito al decadimento, questi ultimi cambiano natura chimica riducendo il proprio numero atomico di due unità. Questo vuol dire che quando un nucleo decade perdendo una particella alfa si forma un nuovo nucleo, più leggero del precedente.
Durante i decadimenti alfa e beta vengono di solito emessi, quasi simultaneamente anche radiazioni elettromagnetiche (fotoni) per compensare lo stato instabile cui perviene il nucleo con l’emissione di particelle alfa e beta. I fotoni non hanno né carica né massa, quindi la loro emissione non comporta un cambiamento delle proprietà chimiche dell’atomo, ma solo la perdita di una determinata quantità di energia sotto forma di radiazione. Il decadimento gamma si ha quando il nucleo di un atomo passa da uno stato instabile ad uno stato più stabile senza variare il numero di protoni e neutroni. Nel passaggio libera energia in eccesso sotto forma di raggi gamma. I raggi gamma sono una forma di radiazione elettromagnetica (fotoni) che trasporta l’energia emessa nelle reazioni che avvengono all’interno del nucleo.
Nella tabella seguente viene indicato il nome dell’elemento radioattivo seguito dal numero di massa, il simbolo che lo rappresenta, il tempo di dimezzamento ed infine il tipo di radiazione emessa.
ELEMENTO RADIOATTIVO |
SIMBOLO |
TEMPO DI DIMEZZAMENTO |
RADIAZIONE EMESSA |
Americio 241 |
|
432 anni |
Alfa |
Plutonio 239 |
|
24400 anni |
Alfa |
Radio 226 |
|
1600 anni |
Alfa |
Radon 222 |
|
3,8 giorni |
Alfa |
Radon (Toron) 220 |
|
55,6 secondi |
Alfa |
Uranio 235 |
|
700 milioni di anni |
Alfa |
Uranio 238 |
|
4,5 miliardi di anni |
Alfa |
Torio 232 |
|
14,05 miliardi di anni |
Alfa |
Stronzio |
|
28 anni |
Beta |
Carbonio 14 |
|
5730 anni |
Beta |
Promezio |
|
2,6 anni |
Beta |
Cesio 137 |
|
30 anni |
Beta - Gamma |
Cobalto 60 |
|
5,3 anni |
Beta - Gamma |
Iridio 192 |
|
74 giorni |
Beta - Gamma |
Potassio 40 |
|
1,28 miliardi di anni |
Beta - Gamma |
Iodio 131 |
|
8 giorni |
Gamma |
Tecnezio 99 m |
|
6 ore |
Gamma |
Xenon 133 |
|
5,2 giorni |
Gamma |
Vi sono inoltre altri particolari tipi di decadimento radioattivo.
Ad esempio un tipo di decadimento, noto come cattura elettronica k, consiste nella cattura di un elettrone orbitale (dai livelli K o L) da parte del nucleo, seguita dalla trasformazione di un protone in un neutrone. Il risultato è la diminuzione di un’unità del numero atomico come nel decadimento b+. La rimozione dell’elettrone dalla sua orbita determina inoltre l’emissione di energia sotto forma di radiazione elettromagnetica.
TAVOLA PERIODICA DEGLI ELEMENTI
1.1 - CENNI STORICI
Lo studio delle radiazioni risale alla fine dell’800.
Nel 1895 Wilhelm Roentgen osservòche quando elettroni veloci urtavano un bersaglio di materiale solido venivano emessi dei raggi che chiamò raggi X.
Nel 1896 il fisico francese Antoine-Henri Becquerel scoprì la radioattività naturale osservando che il minerale di uranio emetteva delle radiazioni invisibili, simili ai raggi x, capaci di impressionare una lastra fotografica (protetta da uno schermo opaco ai raggi luminosi).
Le ricerche iniziate da Becquerel vennero riprese dalla scienziata francese Marie Curie che misurò con precisione l’intensità delle radiazioni emesse da un minerale contenente uranio, la pechblenda. Ella ipotizzò l’esistenza di altri elementi con caratteristiche simili ed introdusse per la prima volta il termine radioattivo per indicare quegli elementi instabili il cui nucleo decadeva con emissione di radiazione.
 |
Nel seguito Marie Curie fu aiutata nelle sue ricerche dal marito Pierre Curie insieme al quale, nel 1898, annunciò la scoperta di altri due elementi radioattivi il polonio ed il radio, come conferma che la proprietà di emettere radiazioni penetranti era comune all’uranio e a molti dei suoi composti. In un secondo tempo venne osservata la radioattività del torio, dell’attinio e del radon. Si comprese subito che la radioattività era la sorgente di energia più concentrata fino ad allora conosciuta. I Curie misurarono il calore associato al decadimento del radio e stabilirono che 1 g di radio produce in un ora un’energia termica di circa 420 J e che questo effetto termico continua ora dopo ora e anno dopo anno. A seguito di questi risultati la radioattività attirò l’attenzione degli scienziati di tutto il mondo e nei decenni successivi furono ampiamente studiati molti aspetti del fenomeno. |
 |
Nel 1903 i coniugi Curie condivisero con Becquerel il premio Nobel per la fisica per la scoperta degli elementi radioattivi. Marie Curie fù la prima donna a ricevere il Nobel, ma soltanto Pierre Curie divenne, nel 1904, professore di fisica all’università di Parigi e, nel 1905, membro dell’Accademia di Francia. Tali incarichi, che spettavano di diritto a Marie Curie, non potevano infatti essere assegnati alle donne. |
La scoperta della radioattività segnò l’inizio di una serie di sistematiche ricerche sulla natura dei costituenti della materia.
Ernest Rutherford scoprì che vi erano almeno due componenti nelle emissioni radioattive. Una costituita da particelle che penetrano solo per alcuni millesimi di centimetro nell’alluminio e che chiamò particelle alfa. L’altra costituita da particelle caratterizzate da un potere penetrante 100 volte maggiore delle particelle alfa, che chiamò particelle beta. Esperimenti successivi, in cui la radiazione venne sottoposta a campi elettrici e magnetici, rivelarono la presenza di una terza componente ad alta energia, i raggi gamma.

La scoperta che il radio-226 decade producendo radon-222 fu la prova conclusiva che il decadimento radioattivo è accompagnato da una trasformazione chimica dell’elemento instabile. Gli esperimenti sulla deflessione dei raggi alfa in un campo elettrico permisero a Rutherford di dedurre che queste particelle sono composte da atomi di elio ionizzati (privati di due elettroni). In seguito si dimostrò che le particelle beta sono elettroni e che i raggi gamma sono radiazioni elettromagnetiche ad alta energia.
Nel 1911, a seguito degli esperimenti di diffusione di particelle alfa da parte di lamine metalliche, Rutherford ipotizzò che l’atomo fosse composto da un nucleo centrale nel quale era concentrata la maggior parte della massa e da un determinato numero di elettroni che orbitavano nello spazio pressoché vuoto intorno al nucleo stesso.
L’ipotesi nucleare da allora si è sviluppata in una teoria complessa della struttura atomica che spiega in modo soddisfacente l’intero fenomeno della radioattività.
2.0 - RADIAZIONI NATURALI ED ARTIFICIALI
Nel corso della sua esistenza un individuo è esposto a radiazioni naturali, sempre presenti nell’ambiente, e a radiazioni artificiali, prodotte dall’uomo per scopi medici ed industriali.

clicca sull'immagine per la versione
ingrandita
Essere esposti alle radiazioni, vuole dire assorbire una certa quantità di energia dovuta alle radiazioni, cioè ricevere una dose di radiazioni. L’esposizione alle radiazioni naturali e/o artificiali è divisa in due categorie:
- esposizione esterna (o esposizione), cioè a tutte quelle radiazioni che dall’esterno interagiscono con il corpo umano;
- esposizione interna (o contaminazione), cioè a tutte quelle radiazioni emesse dai radionuclidi naturali e/o artificiali depositati all’interno del corpo umano mediante l’ingestione o l’inalazione.
Nella seguente tabella sono riportati, a titolo di esempio, i valori in percentuale della dose media assorbita da un individuo della popolazione Italiana.
RADIAZIONI NATURALI |
RADIAZIONI ARTIFICIALI |
Radiazione gamma di origine terrestre 23% |
Irradiazione per scopi medici 28% |
Radiazioni cosmiche 12% |
Rilasci dell’industria nucleare 0,1% |
Irraggiamento interno da radionuclidi naturali (radon, toron, e loro prodotti di decadimento) 35% |
Ricadute radioattive ed esposizione a diverse fonti 2% |
Totale 70% |
Totale 30% |
2.1 - RADIOATTIVITÀ NATURALE
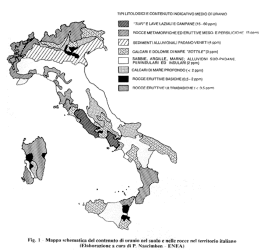
La radioattività naturale può essere considerata la sorgente principale a cui l’uomo è normalmente esposto. Le radiazioni naturali sono da sempre presenti nell’ambiente terrestre. Infatti di tutti gli elementi di cui è composto il nostro pianeta, e quindi anche noi stessi, una parte è costituita da nuclei instabili. Essi sono destinati a trasformarsi, nel tempo, in nuclei stabili e in questo processo di decadimento, vengono emesse radiazioni che costituiscono il fondo naturale di radiazioni. Materiali naturalmente radioattivi sono presenti ovunque: nelle rocce, nel terreno e nei materiali edili, nell’aria e nell’acqua che consumiamo. L’Italia è uno dei paesi in cui è più spiccata la variabilità della radioattività naturale a causa della differenza nella composizione del sottosuolo.
Inoltre siamo bombardati dalla radiazione cosmica di altra origine, proveniente dai corpi celesti all’esterno del pianeta terra. La dose dovuta alla radiazione cosmica aumenta con l’altitudine, come mostrato a titolo di esempio nella tabella seguente.
Altitudine (m) |
Equivalente di dose (mSv/ora) |
Livello del mare |
0,03 |
2000 |
0,1 |
4000 |
0,2 |
12000 |
5 |
20000 |
13 |
I livelli di radioattività naturale possono variare in modo considerevole da una zona all’altra della terra in funzione di molteplici parametri, quali la composizione del suolo, l’altitudine, ecc.. Il livello di radioattività naturale in un luogo può comunque essere considerato una costante caratteristica del luogo stesso. Il fondo di radiazioni naturali fa ricevere 1-3 (mSv/anno) in Italia e perfino 30-60 (mSv/anno) in alcune piccole regioni del mondo.
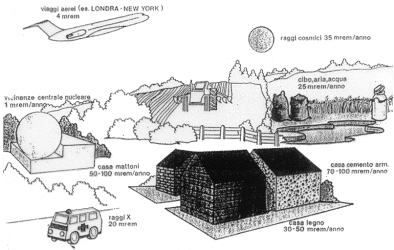
Vediamo alcuni esempi di esposizioni a radiazioni prodotte da sorgenti naturali:
Sorgenti Naturali |
Equivalente di dose (mSv /anno) |
cibo, aria, acqua |
2,5 |
raggi cosmici |
3,8 |
casa in legno |
3,5-5,0 |
radiazioni interne al corpo |
2,5 |
casa in mattoni |
5,0-10,0 |
radiazioni terrestri |
6,1 |
casa in cemento |
7,0-10,0 |
viaggio in aereo (Londra - New York) |
0,4 |
vacanze in montagna (15 gg) |
5,0-10,0 |
2.1.1 - Radon e Toron
Dalle rocce del sottosuolo vengono emessi, in particolare, due elementi radioattivi sotto forma di gas: il radon (radon-222) e il toron (radon-220). Nella tabella periodica degli elementi il radon e il toron si trovano nella famiglia dei gas nobili. L’atomo di radon-222 ha origine dal decadimento del radio-226 (a sua volta originato dal decadimento dell’uranio-238), mentre l’atomo di radon-220 (o Toron) ha origine dal decadimento del radio-224 226 (a sua volta originato dal decadimento del torio-232). Nelle seguenti tabelle vengono riportate le catene di decadimento da cui hanno origine i due gas con specificati i tempi di dimezzamento di ciascun radionuclide e il tipo di radiazioni emesse.
SERIE DI DECADIMENTO DELL’URANIO-238
RADIONUCLIDE |
SIMBOLO |
TEMPO DI DIMEZZAMENTO |
RADIAZIONE EMESSA |
Uranio-238 |
|
4,5 miliardi di anni |
Alfa |
Torio-234 |
|
24,1 giorni |
Beta - gamma |
Protoactinio-234 m |
|
1,17 minuti |
Beta - gamma |
Uranio-234 |
|
240.000 anni |
Alfa |
Torio-230 |
|
77.000 anni |
Alfa |
Radio-226 |
|
1.600 anni |
Alfa |
Radon-222 |
|
3,82 giorni |
Alfa |
Polonio-218 |
|
3,04 minuti |
Alfa |
Piombo-214 |
|
26,8 minuti |
Beta – gamma |
Bismuto-214 |
|
19,9 minuti |
Beta – gamma |
Polonio-214 |
|
0,000164 secondi |
Alfa |
Piombo-210 |
|
22,3 anni |
Beta - gamma |
Bismuto-210 |
|
5,01 giorni |
Beta - gamma |
Polonio-210 |
|
138,4 giorni |
Alfa |
Piombo-206 |
|
Stabile |
--------- |
SERIE DI DECADIMENTO DEL TORIO-232
RADIONUCLIDE |
SIMBOLO |
TEMPO DI DIMEZZAMENTO |
RADIAZIONE EMESSA |
Torio-232 |
|
14,05 miliardi di anni |
Alfa |
Radio-228 |
|
5,75 anni |
Beta - gamma |
Actinio-228 |
|
6,13 ore |
Beta – gamma |
Torio-228 |
|
1,91 anni |
Alfa |
Radio-224 |
|
3,66 giorni |
Alfa |
Radon-220 (Toron:Tn-220) |
|
55,6 secondi |
Alfa |
Polonio-216 |
|
0,15 secondi |
Alfa |
Piombo-212 |
|
10,6 ore |
Beta - gamma |
Bismuto-212 |
|
60,55 minuti |
Beta - gamma |
Polonio-212 |
|
0,00000031 secondi |
Alfa |
Tallio-208 |
|
3,07 minuti |
Beta – gamma |
Piombo-208 |
|
Stabile |
--------- |
In natura i due isotopi del radio, radio-226 e radio-224, si trovano contenuti, insieme ai loro rispettivi "padri", uranio-238 e torio-232, nelle rocce, nei terreni disciolto nelle falde acquifere e nei materiali edili quali per esempio: tufo, pozzolana, lava, cemento ecc... Nella seguente tabella vengono riportati, a titolo di esempio, alcuni materiali da costruzione con i relativi valori di concentrazione di radio-226 e torio-232, espressi come il numero di decadimenti al secondo (Bq) in 1 kg di materiale.
Materiali da costruzione |
Concentrazione di Radio-226 (Bq/Kg) |
Concentrazione di Torio-232 (Bq/Kg) |
Lava del Vesuvio |
700 |
100 |
Pozzolana del Lazio |
350 |
350 |
Tufo del Lazio |
300 |
320 |
Pozzolana della Campania |
180 |
125 |
Peperino del Lazio |
180 |
175 |
Tufo della Campania |
150 |
100 |
Lava dell’Etna |
90 |
80 |
Laterizi |
50 |
50 |
Cemento |
50 |
40 |
Argilla |
50 |
50 |
Pietra |
25 |
<10 |
Sabbia |
25 |
25 |
Gesso naturale |
10 |
<10 |
I materiali edili, utilizzati per
la costruzione degli edifici, emettono una certa quantità di gas
radon e toron che dipende dal materiale da cui ha avuto origine.
I livelli di radioattività che si rilevano in aria all’interno
negli edifici sono dovuti, inoltre, anche al contributo dell’emanazione
di questi gas provenienti dal rocce e dalle falde acquifere del
sottosuolo su cui l’edificio è costruito. Infatti, dal
terreno sottostante l’edificio i gas radon e toron migrano
verso la superficie ed attraverso micro-fessure esistenti nelle
fondamenta entrano nelle case. Un altro possibile contributo di
radioattività dovuta al radon e al toron è dovuto all’acqua.
Le acque sotterranee durante il loro percorso si arricchiscono
degli atomi di radio-226, di torio-232, di radon-222 e toron-220
trasportandoli attraverso gli acquedotti fino ai servizi (bagni e
cucine) presenti negli edifici.
 |
 |
Tali gas, vengono emessi nell’aria che respiriamo e, negli ambienti chiusi o con scarsa ventilazione, possono accumularsi e causare un aumento di livelli di radioattività con conseguenti possibili rischi per la salute delle persone che soggiornano in questi ambienti. In considerazione dell’origine naturale e delle loro caratteristiche di ubiquità, di penetrazione attraverso i materiali e di emanazione, non è possibile eliminare completamente questi gas. E’ possibile, comunque con opportune tecniche, ridurne sia l’emanazione che l’accumulo.
Il radon e il toron con i rispettivi prodotti di decadimento sono considerati, con un rapporto contributivo di circa il 50 %, i maggiori responsabili della dose interna rilasciata ad alcuni tessuti dell’organismo umano in particolare ai polmoni e alle vie respiratorie. Infatti, dopo il fumo essi sono i maggiori responsabili dei tumori indotto ai polmoni.
2.1.2 - Radiazione cosmica
La radiazione cosmica è una radiazione che giunge sulla superficie terrestre, proveniente da tutte le direzioni dello spazio cosmico. Nel 1911-12 il fisico Victor Franz Hess dimostrò, mediante l’uso di palloni sonda, che la ionizzazione dei gas che costituiscono l’atmosfera aumenta con l’altitudine. Perciò essa non poteva avere unicamente origine terrestre (suolo aria), ed Hess dedusse che la radiazione responsabile di questo fenomeno doveva provenire dallo spazio cosmico esterno. Fu poi scoperto che l’intensità della radiazione dipende dalla latitudine e questo vuol dire che le particelle che la costituiscono siano elettricamente cariche e vengano pertanto deflesse dal campo magnetico terrestre.
Al di fuori dell’atmosfera terrestre i raggi cosmici sono fasci di particelle elementari ad alta energia provenienti dallo spazio interstellare, principalmente protoni (87%) e particelle alfa (12%), che viaggiano nello spazio a velocità vicine a quella della luce. Se non ci fosse l’atmosfera che ne assorbe una buona parte, la Terra sarebbe bombardata da alte dosi di radiazione cosmica nociva per gli esseri viventi. Nella fotografia riportata in questa pagina, la collisione di una particella cosmica con un nucleo atomico di una pellicola fotografica ha generato una serie di altre particelle subatomiche di cui si riconoscono le tracce.

I tre parametri principali che caratterizzano le particelle dei raggi cosmici sono la carica elettrica, la massa a riposo e l’energia. Quest’ultima dipende dalla massa e dalla velocità. Tutti i metodi di rivelazione dei raggi cosmici forniscono informazioni circa i precisi legami di queste tre grandezze. L’energia dei raggi cosmici viene misurata in giga elettronvolt (GeV), cioè miliardi di elettronvolt. In media, l’energia immagazzinata nei raggi cosmici della nostra galassia, è dell’ordine di 1 elettronvolt per centimetro cubo. Trattandosi di particelle cariche, anche un campo magnetico molto debole può deviare i raggi cosmici dal loro cammino rettilineo. Il campo magnetico interstellare impedisce quindi ai raggi cosmici di giungere sulla Terra in linea retta, e ciò rende difficile la localizzazione della sorgente. Essi sembrano essere distribuiti in modo isotropo, qualunque valore di energia si consideri. La sorgente dei raggi cosmici non è ancora certa. Nelle fasi attive il Sole, emette raggi cosmici di bassa energia, ma questi eventi sono di gran lunga troppo poco frequenti per spiegare la gran quantità di raggi cosmici rivelati. Neppure le altre stelle simili al Sole sono quindi sorgenti di energia sufficiente. Le esplosioni di supernovae sono responsabili almeno dell’accelerazione iniziale di una frazione significativa di raggi cosmici. Si ritiene che le supernovae siano il luogo di formazione dei nuclei degli elementi pesanti; se esse fossero la sorgente dei raggi cosmici sarebbe facilmente spiegata l’alta percentuale di questi elementi in essi contenuta. L’ulteriore accelerazione potrebbe prodursi nello spazio interstellare come risultato delle onde di shock che si propagano in quelle regioni.